
がんはDNAの異常によって引き起こされる病気です。正常な細胞ではDNAに損傷を受けても修復因子が働いてそれを治してくれます。また治らない場合は細胞周期を止めたり、アポトーシスを起こして細胞を殺し、がん化を防ぐシステムがあります。この機能の異常はDNA損傷の蓄積による発がんを誘発します。しかし一方、がん化したのちのがん細胞にとっては、DNA修復不全は逆に弱点となり、大量なDNA損傷が起こった場合にはこれに対処できず、化学療法や放射線療法に対する感受性が亢進します。このように、DNA修復不全という弱点をついた治療戦略は現在脚光を浴びていて、今後もがん化学療法の主流となっていくでしょう。私たちの仕事の1つはこのようながんの弱点を見つけることです。DNA修復の中心的役割を果たす遺伝子にBRCA1があります。ご存知のようにBRCA1は変異によって約80%という高い確立で家族性乳がんを引き起こすことから、欧米では予防的両側乳房切除術を含めた発症前治療が行われています。BRCA1は全ての増殖する正常細胞に必須の遺伝子で、乳がんや卵巣がんだけでなく、前立腺がんや一部の消化器がんの発症にも重要な役割を果たしています。われわれはBRCA1がユビキチンリガーゼ(E3)という酵素であることを発見し、この酵素活性を中心にその機能を解析しています。
1.BRCA1の機能解析
BRCA1(breast cancer susceptibility gene 1)は家族性乳がん、卵巣がんの原因遺伝子として有名ですが、BRCA1と相互作用をもつタンパク質をコードするたくさんの遺伝子(BRCA2/FANCD1, ATM, CHEK2, BACH1/BRIP1/FANCJ, PALB2/FNACN, RAD51, RAD51C, NBS1, RAD50, TP53)が乳がんの易罹患性に関わることが知られていて、BRCA1の機能解析は乳がんの発がん機構を考える上で重要です。
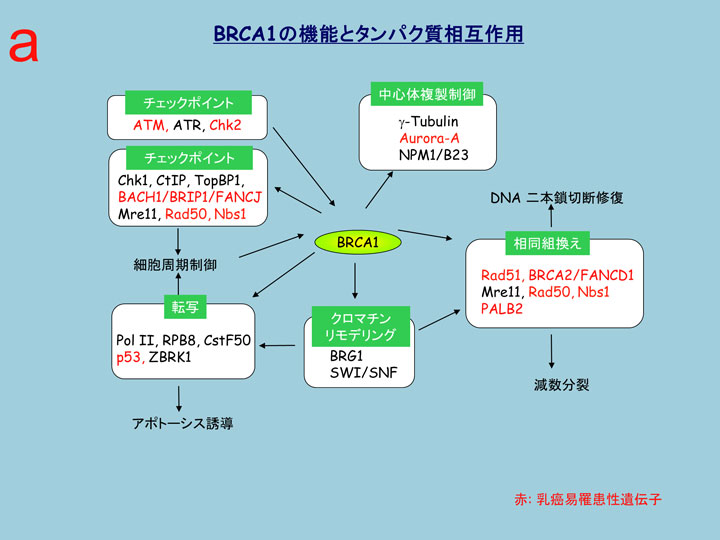
BRCA1はDNAの恒常性を維持するための複数の機能を統括的に制御するハブ蛋白質です(図1-a、以下クリックしながらお読み下さい)。BRCA1が欠損するとこれらの多くの機能が破綻し(b)、その結果乳がんや卵巣がんが生じます(c)。BRCA1異常によって生じる乳がんはbasal-like(基底様)乳がんといって、乳がんの中でも特に予後の悪いタイプです。BRCA1はこれらの機能をはたすために、たくさんのタンパク質と相互作用をしますが、そのそれぞれにはBRCA1のごく一部が関わっているだけです。たとえばBRCA2と結合しているBRCA1は細胞内のBRCA1全体の5%程度です(d)。これに対してBRCA1には、ほとんど常に一緒にいるパートナーがいます。それがBARD1(BRCA1-associated RING domain 1) です(e)。
BARD1はBRCA1と同様にN末端にRINGフィンガードメイン、C末端にBRCTドメインをもっており(f)、BRCA1とRINGフィンガードメイン同士で結合し(g)、RING二量体型のユビキチンリガーゼを形成します(h)。家族性乳がんの原因となるRINGフィンガードメインのミスセンス変異はBARD1との結合を阻害しないM18Tを含め、ユビキチンリガーゼ活性を阻害します(i)。異なった機能を分担するBRCA1複合体としてBRCA1-A, B, CおよびBRCCという4つの複合体が提唱されています(j)。この4つの複合体を含むほとんどの複合体中でBRCA1がBARD1とRING二量体として存在しています。それぞれの機能にBRCA1のユビキチンリガーゼ活性がどのように関わっているかを明らかにしたいと考えています。
 |
| 図1 |
|---|
2.化学療法・放射線療法感受性
がん治療に用いられる化学療法の多くはDNA損傷をきたすことを主な作用とします。例えば乳がんの標準治療として用いられるアントラサイクリン系薬剤(ドキソルビシン、エピルビシン:トポイソメラーゼII阻害によるDNA二本鎖切断(DSB))、シクロホスファミド(DNAクロスリンク)やトリプルネガティブ乳がん、Basal-like乳がんの治療として注目されているプラチナ製剤(シスプラチン、カルボプラチン:DNAクロスリンク→修復の過程でDSBが生じる)、PARP阻害剤(DNA一本鎖損傷→S期特異的DSB)はどれもDNA損傷性の薬剤です。放射線療法もDSBを主な作用としています。
これらの薬剤や放射線療法によるDNA損傷の修復径路は単一なものではありませんが、ここにあげたものの修復ではいずれもBRCA1とBRCA2を介する相同組換え修復(下記)が重要な役割を果たしています。DNA修復不全は少量のDNA損傷が繰り返しおこったときなどはがん化の原因となりますが、化学療法などで一定量以上の損傷が生じたときにはアポトーシスの引き金となります。したがって、がんのDNA修復能を評価することにより、がんの化学療法や放射線療法に対する感受性を予見できると考えられます。教室ではBRCA1を介する相同組換え修復径路を中心に、in vitroや臨床検体によってDNA修復能を評価する研究を進めています。
3.DNA二本鎖切断(DSB)修復径路
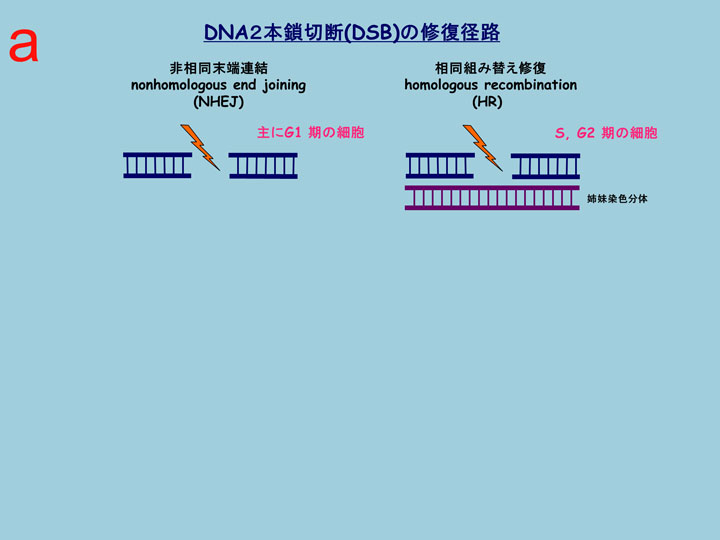
DNA二本鎖切断(DNA double-strand break: DSB)はDNA損傷の中でも最も毒性が強く、修復しにくい損傷ですが、これを修復するには大きく分けて2種類の方法があります(図2-a)。一つは非相同末端連結(none-homologous end-joining: NHEJ)とよばれる切断端を単純に連結するもので、姉妹染色分体の存在しないG1期にはこの経路で修復され、DNA配列のエラーがおきやすい修復方法です(b)。もう一つの修復はS, G2期の主な経路である相同組替え(homologous recombination: HR) 修復で、姉妹染色分体を鋳型とすることで損傷を元通りに修復することが可能です(c)。BRCA1/2はおもにHR修復で働いており、HR修復では必須の役割をはたしています(d)。最近、このHR修復に関わるタンパク質が数多く同定され、その複雑な修復機構が少しずつ明らかになってきています。
修復タンパク質の損傷部位への集積にはユビキチン修飾が重要な役割をはたしており(e)、ユビキチンリガーゼRNF8およびRNF168によってDSB局所に生じたLys63結合型ユビキチン鎖(f)がユビキチン結合ドメイン(UIM)を有するRAP80を介してBRCA1-A複合体(図1-J)をリクルートします(g)。またBRCA1-A複合体中の複数のタンパク質が直接ユビキチン鎖に結合することも報告されています。BRCA1はPALB2を介してBRCA2/RAD51複合体をリクルートし、RAD51によるstrand invasion, 相同組替えがおこりますが(h)、それ以外のこの径路におけるBRCA1の役割はわかっていません。教室ではBRCA1とともに損傷部位に集積するBARD1やBRCA1のユビキチンリガーゼ活性が、この損傷修復過程でどのような役割をはたしているのかを解析しています。私たちはBRCA1-BARD1ユビキチンリガーゼの基質としてヌクレオフォスミン(Nucleophosmin/NPM/NPM1/B23/Numarin)を同定していますが、最近の研究結果から、NPM1がBRCA1-BARD1とともにDSBにリクルートされることを突き止めています(i)。NPM1はリンパ腫や白血病の原因として有名な遺伝子です。
 |
| 図2 |
|---|
4.ユビキチン修飾
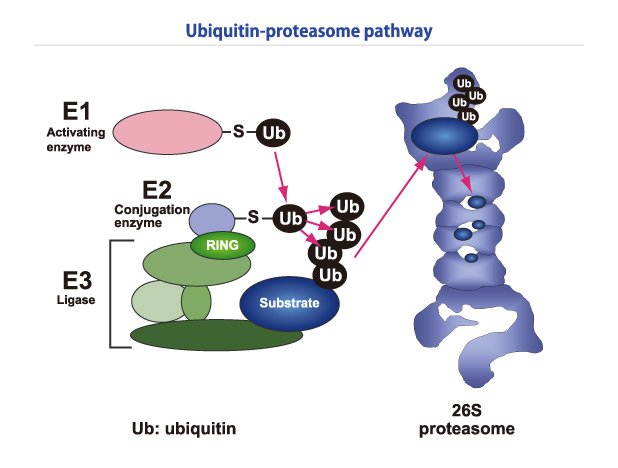
ユビキチンは76個のアミノ酸からなる小さなタンパク質で、基質タンパク質にユビキチンが付加されると(ユビキチン化)、リン酸化やアセチル化などと同じように細胞内のさまざまな機能のためのシグナルとなります。リン酸化がキナーゼ1つの酵素で行われるのに対して、ユビキチン化にはユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチンリガーゼ(E3)という3つの酵素が必要で、ユビキチンのC末端のグリシン残基がATP依存的にE1のシステイン残基に結合し、これがE2に引き渡されて、E3を介して標的タンパク質のリシン(Lys)残基にイソペプチド結合します(図3)。単一分子からなるE1およびE2と異なり、E3は複数の分子よりなることが多く、その中に基質特異性を決定するサブユニットが含まれています。ユビキチン自身にもリシン残基が7つあり、このうちのLys48にさらに次のユビキチンが結合し、この繰り返しによりできたLys48結合型のポリユビキチン鎖は26Sプロテアソームによって認識されて、基質タンパク質の分解のためのシグナルとなります。E3タンパク質の中でE2に結合する部分がRINGフィンガーとよばれるモチーフで、このモチーフはE3タンパク質であることの指標になり、ヒトでは450、植物では490程あると考えられています。
ユビキチン修飾にはLys48結合型ユビキチン鎖だけでなく、ユビキチンが有する全てのLys残基(6, 11, 27, 29, 33, 48, 63)のユビキチン鎖に加え、N末端で連結する直鎖型、単一ユビキチンのみのモノユビキチン化があります。BRCA1-BARD1については、私たちはLys6結合型ユビキチン鎖を触媒することを報告しましたが、今では相互作用するE2によって、モノユビキチン化、Lys6, 48, 63結合型ユビキチン鎖を触媒することが可能であることがわかっています。
それぞれのタイプのユビキチン修飾がさまざまな機能に関わっていて、DNA損傷修復ではヒストンやFANCD2のモノユビキチン化やLys6、Lys63結合型ユビキチン鎖がよく知られています。特にDSBでは上で述べたようにLys63結合型ユビキチン鎖によるDNA修復タンパク質のリクルートが注目されており、当研究室でもユビキチンによってリクルートされるタンパク質の同定やメカニズムの解析を行っています。
 |
| 図3 |
|---|
研究の足跡
現在教室で行っている研究の出発点はノースカロライナ大学、Yue Xiong博士のもとで私が発見した細胞周期制御に必須なROC1 (RING of Cullins) 遺伝子です (Mol. Cell 3:535-41, 1999)。細胞周期の制御を司るSCF(Skp1, Cullin1, F-box)ユビキチンリガーゼ複合体の酵素活性サブユニットであるROC1(Rbx1ともよばれます)を単離したのですが、この際にRINGフィンガーとよばれるモチーフに変異を加えることにより、ユビキチンリガーゼ活性が消失することを世界で初めて証明し、RINGフィンガーモチーフがユビキチンリガーゼという酵素活性の本体であることを突き止めました。この報告に加え同時期に発表された嘉村ら (Science 284:657-61, 1999)、Lorickら (PNAS 96:11364-9, 1999.) の報告からRINGフィンガーモチーフがユビキチンリガーゼ活性を有することが明らかとなり、その後、多数のユビキチンリガーゼが発見され、現在ではヒト細胞内にはROC/Rbx-Cullin複合体をあわせると1000を超えるRING型ユビキチンリガーゼが存在すると考えられています。RINGフィンガーモチーフがユビキチンリガーゼということを知った私は、本学に戻った後、同じくRINGフィンガーを有することが知られていたBRCA1の研究を始めました。その結果BRCA1とBARD1がRING二量体のユビキチンリガーゼを形成し、家族性乳がんの原因となるミスセンス変位によりこの活性が死活することを発見しました(J. Biol. Chem. 276:14537-40, 2001)。これが現在行っている研究の基礎となっています。
by 太田


